Update su diagnosi e strategie di trattamento
Definizione e Patogenesi
La dissezione coronarica spontanea (SCAD) è una delle cause non aterosclerotiche di coronaropatia e si manifesta con un rapporto di 9:1 nelle giovani donne con o senza fattori di rischio cardiovascolari. Deriva dallo sviluppo di un falso lume generalmente nel terzo esterno della tunica media implicando lo sviluppo di un ematoma intramurale (IMH) che comprime il vero lume del vaso, riducendo o addirittura bloccando il flusso coronarico, portando a ischemia miocardica. Grazie a un uso estensivo dell’angiografia coronarica, dell’imaging intravascolare e a una migliore consapevolezza della malattia stessa, le diagnosi di SCAD sono aumentate rispetto al passato.
Presentazione clinica
La SCAD si manifesta abitualmente come una SCA, i pazienti possono pertanto presentare angina instabile, all’infarto miocardico (NSTEMI e STEMI) fino alla morte improvvisa per aritmia ventricolare e arresto cardiaco. La dissezione coronarica dovrebbe pertanto essere sempre sospettata in giovani donne con dolore toracico nel periodo peri-partum e in soggetti giovani con un profilo di rischio cardio vascolare medio-basso.
Strategie diagnostiche
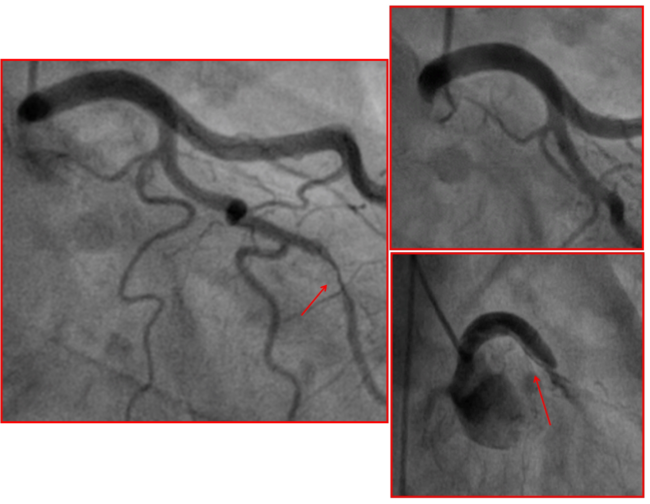
La prima valutazione è sempre basata sull’aspetto angiografico, perché solo attraverso la coronarografia è possibile confermare la diagnosi e classificare la SCAD. A seconda delle caratteristiche angiografiche, si identificano diversi sottotipi. Il Tipo 1 è chiaramente diagnostico raffigurando il tipico “flap” radiolucente con doppio lume. Il Tipo 2 è caratterizzato da una lunga stenosi che, se si estende fino al segmento distale, viene indicata come Tipo 2b, altrimenti come Tipo 2a. Il Tipo 3 invece è agiograficamente indistinguibile da una stenosi focale o stenosi aterosclerotica tubolare. Quest’ultima in particolare richiede ulteriori indagini di imaging intravascolare quali la tomografia a coerenza ottica (OCT) o l’ecografia intravascolare (IVUS), per dimostrare la presenza di IMH e/o doppio lume. Il Tipo 4 prevede l’occlusione totale di un vaso, solitamente distale, in cui sono state escluse fonti di embolia coronarica.
Nel caso in cui l’angiografia non abbia portato a una diagnosi di certezza e il vaso sia di calibro adeguato ad accogliere una sonda OCT/IVUS, si procede con una di queste tecniche di imaging intravascolare, che forniscono una migliore accuratezza diagnostica, ma presentano maggiori rischi e un costo più elevato. L’IVUS presenta una minor risoluzione spaziale, ma ha un potere di penetrazione più profondo rispetto all’OCT, permettendo di visualizzare l’intera parete del vaso, misurando lo spessore e l’estensione dell’IMH, però la sua inferiore risoluzione limita la capacità di rilevare le rotture intimali. L’OCT, d’altra parte, presenta una migliore capacità di rilevare rotture intimali, coaguli intraluminali, falsi lumi, e IMH, ma presenta una penetrazione ottica limitata e richiede una iniezione ad alto flusso e volume di mezzo di contrasto. Pertanto, i problemi insorgono nella visualizzazione delle porzioni più distali, quando il vaso è eccessivamente grande o l’ematoma intramurale ricco di trombi, in questi casi si preferisce usare l’IVUS con modalità ChromaFlo. Solitamente l’OCT è preferito per scopi diagnostici, perché può fornire immagini più chiare sul sito di dissezione rispetto l’IVUS. Naturalmente è possibile effettuare la co-registrazione di OCT o IVUS per meglio identificare l’anatomia del vaso e il posizionamento del catetere.
Anche se entrambe, IVUS e OCT, sono tecniche sicure, ambedue possono causare l’estensione della dissezione con il filo guida, il catetere o l’iniezione di contrasto, causando dissezioni iatrogene e l’occlusione del vero lume. Anche l’angiografia presenta un rischio non indifferente di sviluppo di dissezioni iatrogene in un paziente con SCAD, anche con un’attenta manipolazione dei cateteri. Per questo motivo, si valuta un potenziale ruolo delle tecniche diagnostiche non invasive come l’angioTC e l’angioRM, attualmente non raccomandate come esami di prima linea.
Strategie di trattamento
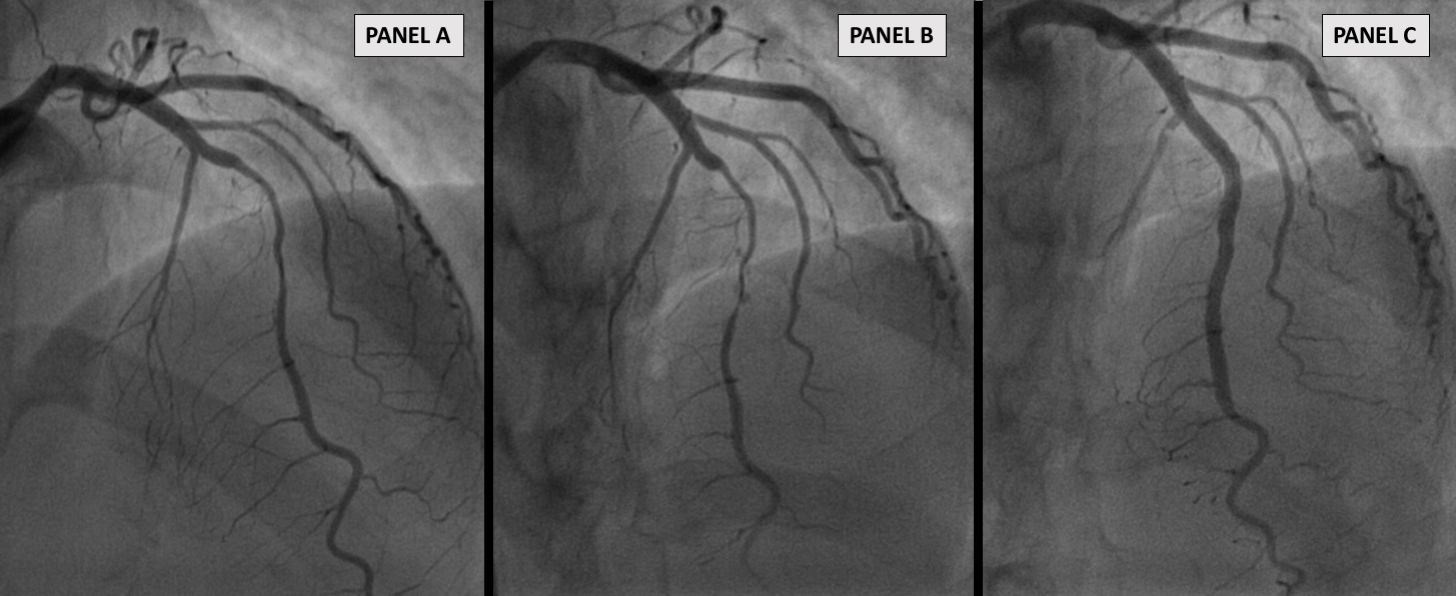
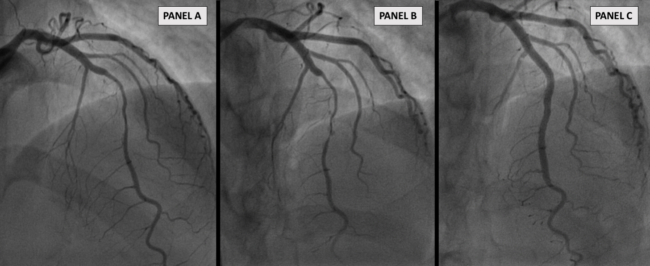
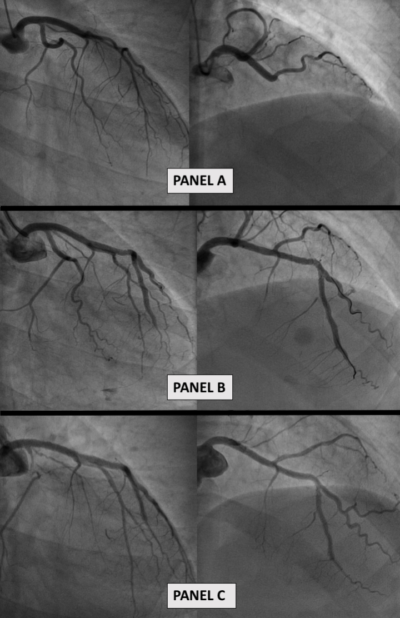
Una gestione interventistica è ad oggi sconsigliata come prima linea a causa dell’elevata percentuale di guarigione spontanea e al significativo tasso di complicanze (Figura 1) associate all’approccio interventistico, (PCI). Le linee guida ASC indicano una DAPT per 12 mesi, associando all’aspirina un potente inibitore del recettore P2Y12. Tuttavia vi è conflitto sull’uso di tali farmaci per le SCAD, la cui fisiopatologia primaria è un sanguinamento intramurale oltre al fatto di esporre i pazienti ad un rischio di sanguinamento o nel caso del sesso femminile a fenomeni di menorragia. In questa panoramica di incertezza, il nostro gruppo ha recentemente pubblicato sull’European Heart Journal uno studio per meglio interpretare l’uso e la durata del trattamento antiaggregante nelle SCAD (Cerrato et al, Eur Heart J 2021 Aug 31;42(33):3161-3171). A 12 mesi, la DAPT è risultata infatti associata a un tasso più elevato di importanti eventi avversi cardiovascolari rispetto alla SAPT, a fronte di un eccesso precoce di infarti miocardici non fatali e PCI non pianificate. Pertanto i dati sembrano confermare l’indicazione ad un trattamento con SAT nei pazienti affetti da SCAD che non vanno incontro a PCI. Questo spettro di incertezza terapeutica rende auspicabile la concretizzazione di studi randomizzati. Solo in caso di instabilità emodinamica, STEMI e altre caratteristiche di rischio, la rivascolarizzazione è ad oggi consigliata. La metodica invasiva utilizzata varia in relazione all’anatomia del vaso dissecante, all’estensione della dissezione. Trattandosi di pazienti giovani, si preferisce utilizzare stent bio-riassorbibili (Figura 2) rispetto a quelli con rilascio di farmaco (Figura 3). Nel caso di un esteso IMH autocontenuto visibile in OCT, l’angioplastica con palloncino permette di ripristinare il flusso, decomprimendo l’ematoma. La PCI è una procedura complessa per la potenziale difficoltà nel posizionare un filo guida nel vero lume e non nel falso lume. OCT e IVUS possono supportare la gestione interventistica fornendo informazioni essenziali sull’IMH e sulla corretta apposizione del filo guida. Infine, nel follow-up, le tecniche di imaging invasive e non, aiutano a valutare il risultato a lungo termine in caso di stenting/scaffolding esteso, forniscono informazioni sulla guarigione spontanea post trattamento conservativo ed escludono l’arteriopatia extracardiaca.