L’imaging cardiovascolare include ecocardiografia, CT ed MRI cardiache e l’IA nelle sue varie forme sta entrando prepotentemente nei calcoli, simulazioni, studio di dettagli anatomo-funzionali e robotica
Le metodiche di imaging cardiovascolare si giovano sempre più dell’ausilio dell’IA
Come stiamo realmente utilizzando questo “mezzo” per calcoli, avanzamenti tecnologici nella realtà clinica?
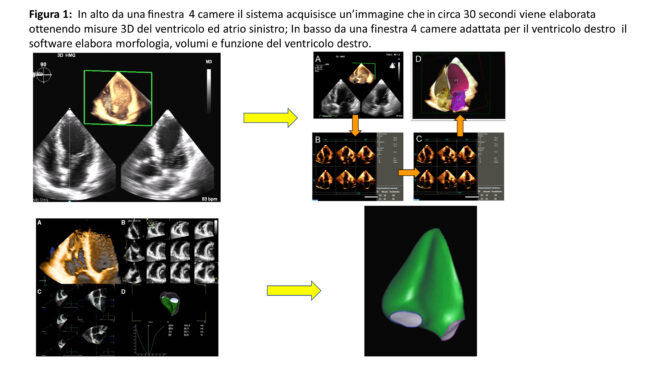
Quando si entra nel campo dell’intelligenza artificiale (IA) la prima impressione è quella di immaginare un mondo futuro ancora poco applicabile nella realtà clinica. In verità invece l’IA sta letteralmente invadendo le nostre attività ed in questa breve rassegna vorrei sintetizzare la nostra esperienza nel campo dell’Imaging cardiovascolare includendo ricerca e soprattutto sviluppo clinico sino alle attuali applicazioni pratiche in atto nel nostro Istituto. I vari utilizzi di cui tratterò entrano nell’aspetto generale dell’IA che dovrebbe: migliorare il work flow diagnostico, ridurre i tempi di acquisizione e calcolo, migliorare la standardizzazione e riproducibilità dei calcoli, fornire diagnosi e prognosi automatiche. Partendo dalle applicazioni in ecocardiografia da circa 5-6 anni abbiamo contribuito scientificamente collaborando con il gruppo di Chicago guidato da Roberto Lang alla validazioni di IA nel calcolo automatico dei volumi del ventricolo ed atrio sinistro e successivamente del ventricolo destro.(1, 2) Il software (ormai da tempo commerciale) riconosce la morfologia delle camere, ne valuta volumi e funzione e traccia curve funzionali. Il metodo è quello del deep learning “supervised”. Di fatto sulla base di migliaia di casi di eco 3D e Risonanza magnetica il sistema riconosce forme e dimensioni delle cavità cardiache confermate o smentite da esperti e tanto più esempi e riconoscimenti di tracce endocardiche vengono eseguiti e validati tanto più la l’accuratezza migliora. La Figura 1 mostra esempi di ricostruzioni dinamiche delle camere cardiache ed i calcoli che possono essere ottenuti. Il vantaggio fondamentale è che calcoli 3D che richiederebbero complessi passaggi sull’ecografo o su software off-line con tempi lunghi possono essere eseguiti in media in 30 secondi per atrio e ventricolo sinistro e 20 secondi per il ventricolo destro. Di fatto attualmente nei nostri laboratori abbiamo su 30 ecocardiografi dell’Istituto ben 4 unità che hanno questi software (Figura 1) con acquisizione/calcoli che sono utilizzati routinariamente.
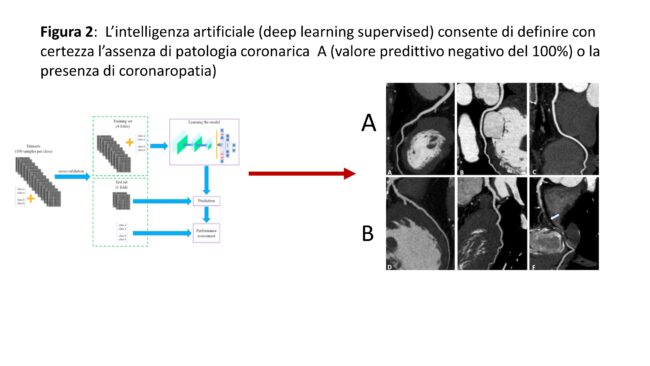
Nella pratica non utilizziamo però in tutti i casi i calcoli 3D automatici, ma nei casi in cui le immagini sono ottimali (90% fattibilità), e vi sia un’indicazione clinica specifica. In fibrillazione atriale la fattibilità è dell’80% circa. Il limite o se vogliamo la problematica attuale è che il software è stato validato verso la risonanza magnetica e tutti gli studi dimostrano che i volumi del ventricolo sinistro e destri risultano superiori a quelli dei calcoli 2D o 3D tradizionali e lievemente sottostimati rispetto alla risonanza. La frazione di eiezione è invece ben correlata. Nei nostri referti manteniamo (anche per facilitare confronti) i dati 2D e 3D classici e riportiamo separatamente nel referto anche i dati ottenuti con IA. Vi è discussione se nel prossimo futuro i dati ecocardiografici 2D/3D debbano “rincorrere” il gold standard RMN o se i dati ecocardiografici debbano rimanere a se stanti. Nel campo sempre di calcoli e riconoscimenti automatici abbiamo impostato studi su CT ed MRI cardiaca(3, 4). Tra i vari dati interessanti l’IA (sempre deep learning supervised) permette di riconoscere con valore predittivo negativo altissimo (pressoché 100%) una TAC coronarica con vasi normali evitando calcoli complessi in assenza di patologia con ampio risparmio di tempo, tempo che dedichiamo allo studio approfondito delle caratteristiche anatomiche e di flusso dei segmenti coronarici patologici (Figura 2). Sia in CT e MRI è inoltre possibile riconoscere in modo automatico segmenti fibrotici e classificarne sede ed entità.
In alcuni studi immagini fibrotiche miocardiche non riconoscibili dal nostro occhio sono comunque classificabili come patologiche dall’IA rendendosi complementari a contrasti o sequenze specifiche. Diviene quindi molto più agevole classificare miocardio sano e patologico con ovvie ricadute cliniche. Vi sono poi molti studi sulla possibilità che l’IA permetta diagnosi automatiche. La letteratura si arricchisce ogni giorno di nuovi dati, ma ad oggi non stiamo utilizzando l’IA in questa direzione nella pratica clinica. Infine vi è un aspetto che riguarda IA e reti neurali. Costantemente stiamo passando dalla statistica tradizionale e utilizzo di multivariate alle reti neurali per gli studi prognostici(5-8). Questi algoritmi permettono di scoprire il peso di ogni co-variata ed aiutano a dimostrare la rilevanza di alcuni parametri in casistiche complesse. Due soli esempi. Nelle TAVI abbiamo evidenziato che la presenza di un coesistente rigurgito mitralico su base organica è un potente predittore di mortalità a 3 anni (contrariamente ai dati della letteratura). Questo evidentemente è un aspetto importante se si ritiene di abbassare l’età di impianto TAVI in pz bivalvolari, casi nei quali va valutata con attenzione l’indicazione cardiochirurgica “classica”. Nel campo del rigurgito mitralico da prolasso abbiamo poi osservato come l’esame 3D transtoracico preoperatorio possa non solo identificare la probabilità di riparazione chirurgica (casi con prolassi meno complessi e chirurgia riparativa “semplice”), ma anche predire la ricorrenza di rigurgito a medio termine. Il solo dato 3D transtoracico pre-operatorio ha quindi la possibilità di facilitare le scelte chirurgiche e discutere con pz e colleghi la migliore strategia (es. più attendista con follow-up o più aggressiva con plastica in fase precoce). Vi sarebbero moltissimi altri aspetti, ma ne cito un ultimo che si inserisce nel campo della realtà virtuale o aumentata. Nella fase pre-procedura di chiusura percutanea dell’auricola sinistra si creano immagini olografiche dell’auricola sinistra a partenza di una TAC. Con occhiali olografici 2 operatori da qualsiasi distanza possono discutere il caso (morfologia, dimensioni, varianti anatomiche dell’auricola), scegliere il device ottimale e forse nel futuro eseguire la procedura in robotica.
Bibliografia:
- Tamborini G, Piazzese C, Lang RM, Muratori M, Chiorino E, Mapelli M, Fusini L, Ali SG, Gripari P, Pontone G, Andreini D, Pepi M. Feasibility and Accuracy of Automated Software for Transthoracic Three-Dimensional Left Ventricular Volume and Function Analysis: Comparisons with Two-Dimensional Echocardiography, Three-Dimensional Transthoracic Manual Method, and Cardiac Magnetic Resonance Imaging. J Am Soc Echocardiogr. 2017 Nov;30(11):1049-1058. doi: 10.1016/j.echo.2017.06.026
- Italiano G, Tamborini G, Fusini L, Mantegazza V, Doldi M, Celeste F, Gripari P, Muratori M, Lang RM, Pepi M. Feasibility and Accuracy of the Automated Software for Dynamic Quantification of Left Ventricular and Atrial Volumes and Function in a Large Unselected Population. J Clin Med. 2021 Oct 28;10(21):5030. doi: 10.3390/jcm10215030.
- Muscogiuri G, Martini C, Gatti M, Dell’Aversana S, Ricci F, Guglielmo M, Baggiano A, Fusini L, Bracciani A, Scafuri S, Andreini D, Mushtaq S, Conte E, Gripari P, Annoni AD, Formenti A, Mancini ME, Bonfanti L, Guaricci AI, Janich MA, Rabbat MG, Pompilio G, Pepi M, Pontone G. Feasibility of late gadolinium enhancement (LGE) in ischemic cardiomyopathy using 2D-multisegment LGE combined with artificial intelligence reconstruction deep learning noise reduction algorithm. Int J Cardiol. 2021 Nov 15;343:164-170. doi: 10.1016/j.ijcard.2021.09.012.
- Muscogiuri G, Chiesa M, Trotta M, Gatti M, Palmisano V, Dell’Aversana S, Baessato F, Cavaliere A, Cicala G, Loffreno A, Rizzon G, Guglielmo M, Baggiano A, Fusini L, Saba L, Andreini D, Pepi M, Rabbat MG, Guaricci AI, De Cecco CN, Colombo G, Pontone G. Performance of a deep learning algorithm for the evaluation of CAD-RADS classification with CCTA. Atherosclerosis. 2020 Feb;294:25-32. doi: 10.1016/j.atherosclerosis.2019.12.001.
- Tamborini G, Mantegazza V, Penso M, Muratori M, Fusini L, Ali SG, Cefalù C, Italiano G, Volpato V, Gripari P, Caiani EG, Zanobini M, Pepi M. Predictive Value of Pre-Operative 2D and 3D Transthoracic Echocardiography in Patients Undergoing Mitral Valve Repair: Long Term Follow Up of Mitral Valve Regurgitation Recurrence and Heart Chamber Remodeling. J Cardiovasc Dev Dis. 2020 Oct 20;7(4):46. doi: 10.3390/jcdd7040046.
- Penso M, Pepi M, Mantegazza V, Cefalù C, Muratori M, Fusini L, Gripari P, Ghulam Ali S, Caiani EG, Tamborini G. Machine Learning Prediction Models for Mitral Valve Repairability and Mitral Regurgitation Recurrence in Patients Undergoing Surgical Mitral Valve Repair. Bioengineering (Basel). 2021 Aug 25;8(9):117. doi: 10.3390/bioengineering8090117.
- Penso M, Pepi M, Fusini L, Muratori M, Cefalù C, Mantegazza V, Gripari P, Ali SG, Fabbiocchi F, Bartorelli AL, Caiani EG, Tamborini G. Predicting Long-Term Mortality in TAVI Patients Using Machine Learning Techniques. J Cardiovasc Dev Dis. 2021 Apr 16;8(4):44. doi: 10.3390/ jcdd8040044.
- Penso M, Moccia S, Scafuri S, Muscogiuri G, Pontone G, Pepi M, Caiani EG. Automated left and right ventricular chamber segmentation in cardiac magnetic resonance images using dense fully convolutional neural network. Comput Methods Programs Biomed. 2021 Jun;204:106059. doi: 10.1016/j. cmpb.2021.106059.