IA ed imaging multimodale cardiologico: ci possiamo fidare?
Come superare lo scetticismo verso la IA e perché lasciarsi sedurre da suoi potenziali vantaggi nella pratica clinica
Ho letto con interesse ed apprezzato gli articoli sull’intelligenza artificiale (IA) pubblicati nel forum di questa rivista. In realtà molti dei punti relativi alla sua mancata applicazione nell’arena clinica sono stati adeguatamente sviscerati e sono tutti largamente condivisibili, il mio sarà il punto di vista del Cardiologo clinico, esperto di imaging, che ha praticato la sua attività di Cardiologo ospedaliero con occhio attento alla ricerca ed alle novità proposte dalla letteratura scientifica sia in centri spoke sia in centri hub di riferimento. L’IA è considerata ad oggi una valida alternativa ai tradizionali modelli statistici basati sulla regressione (es. regressione logistica) in diversi ambiti della medicina: work-up diagnostico, stratificazione del rischio e predizione della prognosi. La crescente disponibilità di database sempre più grandi e ricchi di dati, anche grazie all’affermarsi delle cartelle elettroniche, così come la maggiore inclinazione all’overfitting da parte degli algoritmi basati sull’IA, ha suscitato curiosità ed entusiasmo nei confronti di questo approccio innovativo. Il tema dell’interpretazione è particolarmente rilevante in medicina, ambito in cui l’evidenza e le argomentazioni a sostegno di una previsione sono talora importanti quanto la previsione stessa. Il problema principale è che l’IA viene vissuta dai clinici come una metodica dei cui risultati è necessario fidarsi a scatola chiusa, immaginate la nostra generazione abituata alla guida delle auto con le marce che ha snobbato il cambio automatico, figuriamoci se possa abituarsi al “pilota automatico”. Questa diffidenza, nell’ambito dei Cardiologi che si occupano di imaging, trova terreno fertile nelle difficoltà quotidiane di reperire parametri misurabili in maniera oggettiva che riducano la variabilità inter-osservatore e spesso anche intra-osservatore con inevitabile ricaduta sull’accuratezza diagnostica. Gli esempi in questo ambito sono tanti, a partire da una misura lineare apparentemente semplice come quella del diametro intraventricolare sinistro con M-mode (che ancora oggi conserva il suo valore tanto da essere citato nelle linee guida) fino alla stima dei volumi ventricolari e quindi della frazione di eiezione con il metodo di Simpson biplano. Alzi la mano chi non ha mai sperimentato valori diversi di frazione di eiezione in misurazioni diverse nello stesso paziente? Eppure, anche la FE è un parametro citato dalle linee guida e cut-off precisi di frazione di eiezione entrano in snodi decisionali fondamentali in diverse situazioni nella gestione di pazienti complessi con patologie cardiovascolari. Allo stesso modo di recente un altro importante parametro di funzione sistolica il global longitudinal strain risente non solo delle differenze che esistono nelle modalità di calcolo dello strain miocardico mediante speckle tracking echocardiography tra i vari vendors ma anche dalla qualità delle immagini acquisite e dalla finestra acustica del paziente. È esperienza comune nell’applicare questa metodologia la necessità di dover intervenire per correggere la stima automatica dello strain da parte della macchina facendola diventare quindi non più un calcolo automatico bensì semi-automatico. Se consideriamo altre metodiche di imaging, ad esempio la Risonanza Magnetica, a dispetto della considerazione generale, resta comunque una metodica operatore-dipendente sia nella fase realizzativa che nella fase interpretativa. Negli ultimi anni anche la cardio-TC ha riportato enormi sviluppi sia nella valutazione morfologica che in quella funzionale del cuore, si pensi ad esempio alla coro-TC che ha cambiato l’iter diagnostico del paziente ischemico. La recente emergenza sanitaria, legata alla pandemia, ha fatto emergere forte la necessità da una parte di integrare le informazioni derivanti da più metodiche, dall’altra di ridurre l’impiego di metodiche diagnostiche, in altre parole la necessità di sintesi delle informazioni per migliorare la gestione clinica. A tale proposito, il ruolo della TC utilizzata soprattutto per la diagnosi della complicanza più frequente e temibile dei pazienti affetti da infezione con SARS Coronavirus-2 cioè la polmonite interstiziale, è stato allargato alla possibilità di escludere, in un quadruplo rule-out, altre possibili complicanze come ad esempio l’embolia polmonare, la cardiopatia ischemica da aterosclerosi coronarica e persino le miocarditi. Infatti, l’impiego di specifici mezzi di contrasto consente anche con TC un’analisi di caratterizzazione tessutale utile a riconoscere aree miocardiche coinvolte da processi infiammatori. Tutto ciò in una sorta di one-stop shopping permetterebbe di escludere o diagnosticare non solo la polmonite ma anche altre importanti patologie. Purtroppo, queste potenzialità sono espresse al momento solo in pochi centri di eccellenza e restano prerogativa di pochi gruppi che hanno maturato una adeguata expertise. In ambito cardiologico, inoltre, non va trascurata la possibilità di artefatti legati a possibili alterazioni del ritmo cardiaco o ad altre cause. Tutte queste problematiche probabilmente giustificano la diffidenza verso l’IA del Cardiologo clinico, già in difficolta a gestire in maniera oggettiva informazioni non sempre concordanti fornite dall’imaging multimodale e costretto a chiedersi quanto convenga affidarsi a un software di IA per eseguire automaticamente una procedura time consuming se il risultato va comunque, a volte anche spesso, rielaborato. Oppure, quanto sia possibile, anche per l’esperto, dubitare dell’esito di una elaborazione automatica piuttosto che, per il Cardiologo meno esperto, fidarsi ciecamente dei risultati ottenuti. Per provare a superare questo limite, si dovrebbe fare uno sforzo per standardizzare la validità delle informazioni acquisite da ciascuna metodica che entrano nell’algoritmo decisionale che a sua volta porta all’elaborazione del risultato. Quest’aspetto non è secondario perché se vogliamo che l’IA funzioni dobbiamo mettere a disposizione dati “puliti” e quanto più possibili “veritieri” per poter avere le informazioni che servono a rispondere a specifici quesiti. Tuttavia se ci si impegna a superare l’iniziale diffidenza nei confronti dell’IA, spuntano all’orizzonte interessanti prospettive da considerare. L’IA applicata all’imaging cardiovascolare può individuare nuovi pattern anatomici rilevanti nel work-up diagnostico e nella stratificazione del rischio. Questo aspetto può essere di spunto per nuove riflessioni di carattere scientifico, generare ipotesi ed infine nuova conoscenza.
Quali sono i vantaggi che offre l’IA?
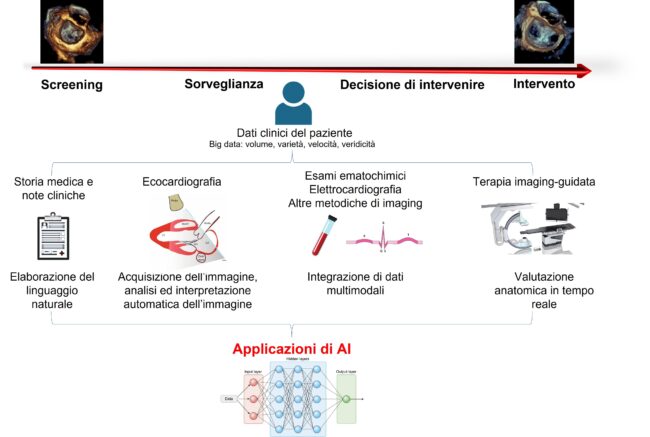
Lo sforzo che dobbiamo fare è capire che l’IA ci può dare la possibilità di gestire i cosiddetti “big data”, cioè un ampio volume di dati (clinici, elettrocardiografici, di imaging multimodale etc.) derivanti da fonti diverse con possibili differenze in termini di concordanza e “veridicità”. Un altro vantaggio è quello di usufruire di una rapida capacità di integrare parametri diversi per analizzare e investigare aspetti specifici fornendo velocemente ipotesi diagnostiche conclusive in tempo reale. A seconda del tipo di problematica, possono essere applicati differenti algoritmi che tengano conto dei big data. Il modello più largamente utilizzato, specie nell’ambito dell’imaging medico, è il cosiddetto CNN (Convolutional Neural Network). Il CNN si basa sulla struttura della corteccia visiva del cervello e funziona identificando le caratteristiche cruciali che servono a identificare immagini specifiche associate a quadri patologici peculiari.
Come possiamo ottenerli?
Per rispondere a questa domanda mi viene da pensare all’applicazione dell’IA nella diagnosi delle valvulopatie e il suo possibile impatto nella gestione clinica dei pazienti che ne risultano affetti. L’applicazione dell’IA all’imging, per esempio all’ecocardiografia, dovrebbe riguardare almeno quattro ambiti:
- la fase di acquisizione delle immagini,
- l’identificazione di “view” specifiche,
- la segmentazioni di parti anatomiche di interesse,
- l’identificazione dello stato di progressione della malattia.
In altre parole, dopo aver verificato il corretto procedimento di acquisizione attraverso un “controllo di qualità” esistono software in grado di rilevare specifiche regioni anatomiche e software in grado di riconoscerne altre nel loro contesto sulla base di parametri morfologici. Infine, algoritmi che analizzano strutture anatomiche nella complessità del loro movimento, si pensi ai ventricoli o ad una valvola complessa come la mitrale, identificando immagini che permettano una lettura seriata di misurazioni automatizzate in grado di riconoscere attraverso algoritmi specifici (machine learning, deep learning) predittori di outcome avverso. Tutto questo sarebbe fondamentale per una più fine caratterizzazione della patologia del paziente e per stabilire non solo lo stato di progressione della patologia, ma anche il cosiddetto phenotyping, cioè l’identificazione di fenotipi specifici con prognosi diversa e differenti livelli di rischio.
Quale può essere il ruolo dell’IA nella medicina del futuro?
Innanzitutto, dobbiamo pensare all’IA come qualcosa che non sostituisce il medico ma che aiuta il medico a gestire al meglio i propri pazienti, fornendogli la possibilità di integrare rapidamente dati anamnestici, clinici, biochimici, elettrocardiografici, di imaging multimodale. Questo obiettivo sarà raggiunto quando chi si occupa della costruzione dei modelli di IA e chi si occupa della pratica clinica inizieranno a parlare un linguaggio comune e se l’IA sarà in grado di fornire indicatori di prognosi (hard) in termini di sopravvivenza, qualità della vita, nonché tali da indirizzare le più opportune strategie terapeutiche e/o interventistiche, sia chirurgiche che percutanee. In merito al supporto diagnostico dell’IA, in pazienti che si presentano con un quadro di sindrome coronarica acuta potrebbe essere utile, con il supporto di software appositi, ottenere la diagnosi differenziale fra forme diverse di sindrome coronarica acuta e sindrome Takotsubo che ha un percorso gestionale e terapeutico differente da quello con infarto miocardico classico STEMI. Ritornando all’esempio della gestione delle valvulopatie, sarebbe di grande aiuto poter avere dei modelli in grado di stabilire in pazienti con insufficienza mitralica da sottoporre a MitraClip prima della procedura dove posizionare la clip, di quante clip abbiamo bisogno, di quanto potremmo ridurre il volume rigurgitante, quale sarà lo stress sui lembi mitralici che l’impianto delle clip andrà a generare e nei casi di insufficienza mitralica funzionale quale sarà lo stress a cui andrà incontro il ventricolo in seguito al trattamento (Figura 1). Un sapiente utilizzo dell’IA da personale addestrato consente di migliorare la qualità delle immagini acquisite, di elaborarle per ottenere dati altrimenti non fruibili, di risparmiare tempo e, di conseguenza, ridurre i costi. Il beneficio maggiore lo ha sicuramente il paziente, perché l’IA può diventare uno strumento in più per arrivare a diagnosi sempre più precise ed a personalizzare la terapia. Quest’ultimo aspetto diventa di enorme interesse attuale specie in pazienti complessi con molteplici comorbidità in cui siamo costretti a ricorrere, per ubbidire alle varie linee guida, ad un vasto armamentario terapeutico senza tener conto delle interazioni tra i vari farmaci e dei possibili effetti negativi della “multiterapia” su vari organi e apparati. Se si tengono in mente tutti questi aspetti si può guardare con fiducia all’IA in ambito cardiovascolare considerandola uno strumento al servizio dell’intelligenza clinica del Cardiologo e mai viceversa.