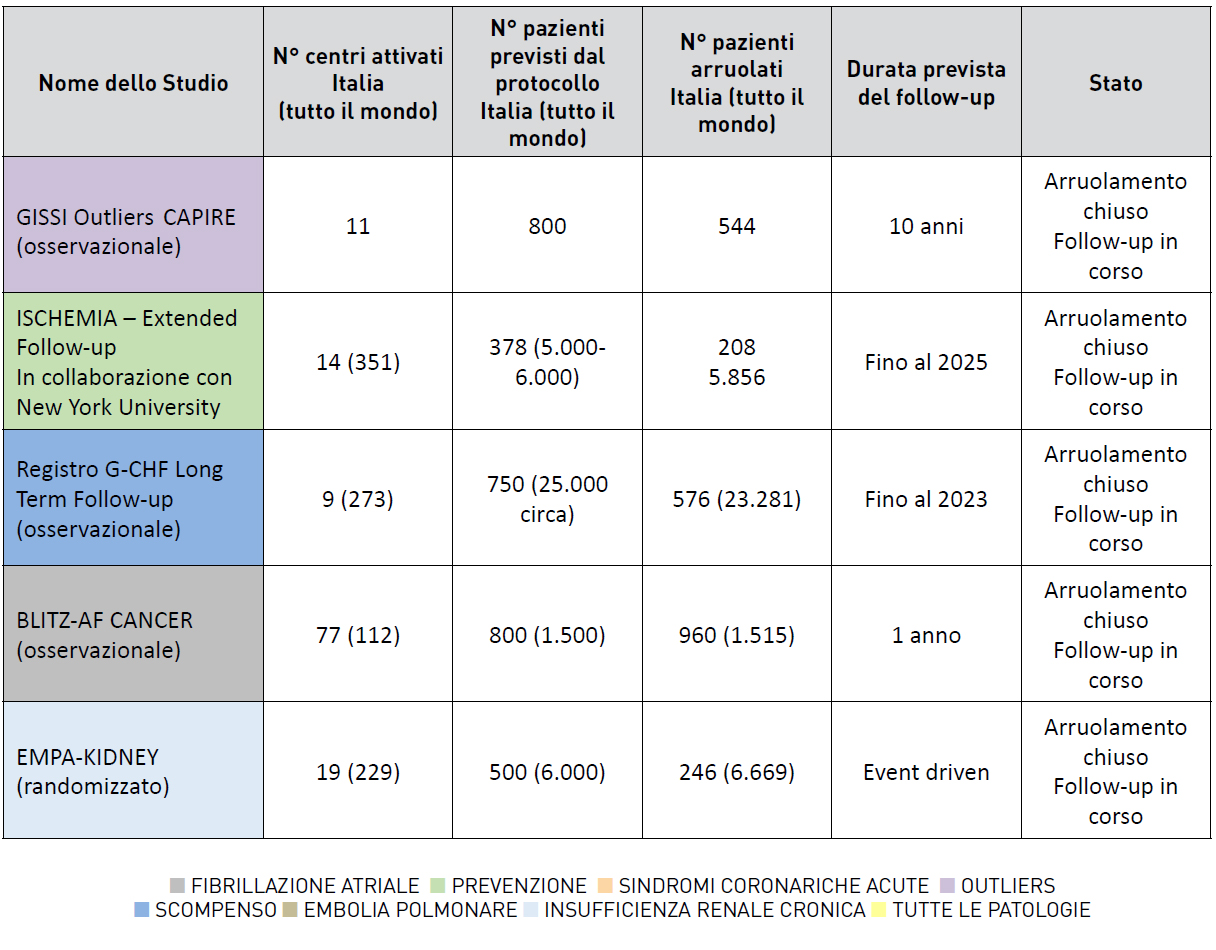
EMPA -KIDNEY Trial
I pazienti con accertata malattia renale cronica (CKD) corrono un elevato rischio di progredire verso lo stadio terminale della malattia renale nonostante l’uso di terapie mediche, incluso il blocco del sistema renina-angiotensina: identificare nuovi trattamenti per ritardare la progressione della malattia renale è pertanto una priorità. Inoltre, i pazienti con CKD sono ad alto rischio di morte per causa cardiovascolare e di scompenso cardiaco, eventi che possono a loro volta essere ridotti dall’uso di empagliflozin. L’inibizione selettiva del cotransportatore- 2 sodio-glucosio (SGLT-2) con empagliflozin provoca una escrezione urinaria di glucosio e riduce l’iperglicemia, il peso corporeo, il volume circolante plasmatico e la pressione arteriosa. E’ stato dimostrato che, nelle persone con diabete di tipo 2 e con malattia cardiovascolare accertata, questi effetti si traducono in una riduzione del rischio di malattie cardiovascolari (in particolare insufficienza cardiaca e morte per causa cardiovascolare) senza problemi rilevanti di sicurezza. Poiché l’inibizione di SGLT-2 con empagliflozin causa glicosuria e modificazioni emodinamiche acute della funzione renale anche nelle persone senza diabete, è stato ipotizzato che empagliflozin possa avere un effetto nefroprotettivo anche in assenza di iperglicemia, cioè nel 50-70% dei pazienti con CKD in tutto il mondo. In questa ottica è stato disegnato dall’Università di Oxford lo studio EMPA-KIDNEY, studio clinico multicentrico internazionale randomizzato in doppio cieco, controllato con placebo, per valutare l’effetto di empagliflozin sugli esiti cardio-renali in pazienti adulti con CKD. EMPA-KIDNEY include pazienti con CKD meno rappresentati negli altri trial con inibitori del SGLT-2: pazienti con malattia renale non diabetica indipendentemente dall’eGFR/UACR; pazienti con malattia renale diabetica con bassi livelli di albuminuria; pazienti con bassi livelli di funzione renale di base (ad es. eGFR <30) tipici dei pazienti seguiti in nefrologia. Lo studio confronta empagliflozin 10 mg una volta al giorno rispetto al placebo, somministrati “on top” alla migliore terapia ad oggi conosciuta, in più di 6600 pazienti con CKD accertata, con o senza diagnosi di diabete mellito, e trattati con una dose clinicamente appropriata di un bloccante del sistema reninaangiotensina (se tollerato). L’obiettivo primario è di valutare l’effetto di empagliflozin sull’endpoint composito di morte per causa cardiovascolare o progressione della malattia renale (definita come end stage kidney disease, un declino prolungato di eGFR fino a <10 mL/min/1.73m2, morte da causa renale o un declino prolungato di eGFR ≥40% rispetto al valore alla randomizzazione). Gli obiettivi secondari principali sono di valutare l’effetto di empagliflozin sulla morte per causa cardiovascolare o sul ricovero per scompenso cardiaco, sul ricovero per qualsiasi causa e sulla mortalità per qualsiasi causa. Sono inoltre previste altre valutazioni, in particolare le analisi sulla sicurezza del farmaco. Lo sponsor è Boehringer Ingelheim (BI) che ha delegato all’Università di Oxford la responsabilità della conduzione e dell’analisi dello studio. I Paesi partecipanti (UK, USA, Canada, Germania, Giappone, Cina, Malesia, Italia) sono coordinati a livello internazionale dalla Clinical Trial Service Unit (CTSU) dell’Università di Oxford, e da Centri di Coordinamento Nazionali tra i quali, per l’Italia, il Centro Studi ANMCO della Fondazione per il Tuo cuore. La randomizzazione dei pazienti è iniziata a livello internazionale a maggio 2019 e in Italia, invitata successivamente, a settembre 2020. Stanno partecipando ad EMPAKIDNEY 19 centri di nefrologia italiani che hanno complessivamente randomizzato 246 dei 6609 pazienti dello studio. Purtroppo l’attivazione dello studio in Italia è coincisa con l’inizio della pandemia COVID-19 comportando un forte ritardo nella fase regolatoria, e a seguire criticità per l’arruolamento dei pazienti. Il 7 marzo 2022, il Data Monitoring Committee, dopo aver valutato i risultati dell’analisi ad interim di efficacia pre-specificata nel protocollo, ha raccomandato allo Steering Committee, che ha accettato la raccomandazione, di chiudere il trial anticipatamente per una evidenza di chiara efficacia terapeutica. A breve inizieranno pertanto le visite di fine studio con l’intento di presentare i risultati nel corso del 2022 e di pubblicarli in contemporanea.