Spessori parietali miocardici aumentati: come orientarsi
Breve rassegna sulle condizioni di ipertrofia miocardica
Secondo le ultime linee guida ESC le cardiopatie a fenotipo ipertrofico vengono classificate in “primitive”, nelle condizioni in cui il cuore è l’unico organo coinvolto, e “secondarie”, quando l’ipertrofia miocardica è la manifestazione di una patologia sistemica.
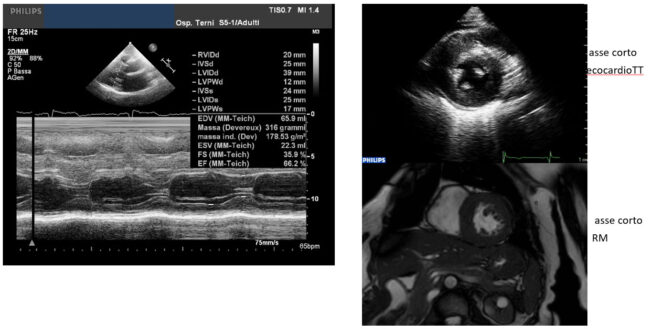
La definizione di ipertrofia ventricolare sinistra viene confermata con l’analisi dei diametri e degli spessori ventricolari, secondo cutoff ben noti, da cui derivano anche i criteri diagnostici per la Cardiomiopatia ipertrofica (CPMI). Lo studio ecocardiografico dell’ipertrofia ventricolare sinistra deve prevedere diversi aspetti, tra cui il rapporto tra l’aumento degli spessori parietali e le dimensioni della cavità ventricolare (es. relative wall thickness) e lo studio della distribuzione dell’ipertrofia stessa, che può coinvolgere in maniera omogenea e le pareti ventricolari, oppure può riguardare peculiarmente alcuni distretti miocardici, come nel caso dell’ipertrofia apicale dei segmenti medi ventricolari oppure della porzione suboartica del setto interventricolare,condizione piuttosto frequente nella popolazione anziana.
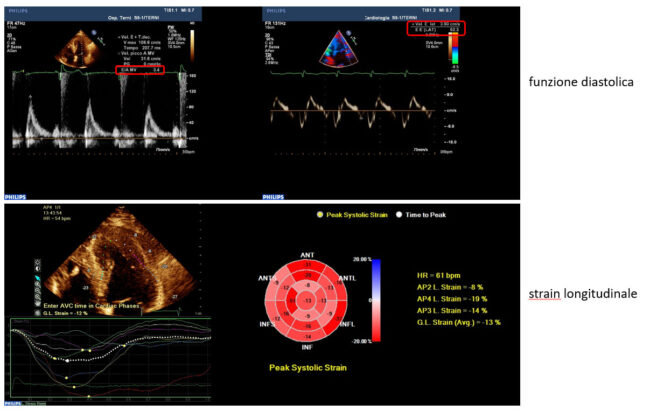
La diagnosi etiologica dell’ipertrofia ventricolare deve contestualizzare i dati strumentali per la diagnosi differenziale tra le forme secondarie (ad esempio la cardiopatia ipertensiva, con frequente coesistenza di dilatazione atriale sinistra ed ectasia aortica) e quelle primitive cardiache: in caso di CMPI, ad esempio, può coesistere l’impianto anomalo dei muscoli papillari o la presenza di concomitanti anomalie dell’apparato valvolare mitralico, anche predisponenti l’ostruzione all’efflusso ventricolare. Oltre alla valutazione morfologica l’esame ecocardiografico prevede lo studio delle performance ventricolari: nella maggior parte dei casi la rigidità delle pareti soggette ad ipertrofia (con secondaria fibrosi della matrice extracellulare) induce gradi variabili di disfunzione diastolica ed aumento delle pressioni telediastoliche.
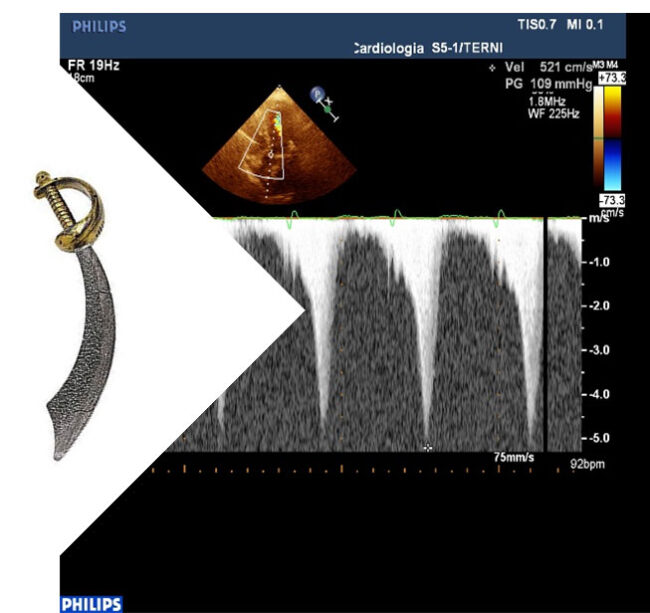
La disfunzione diastolica, insieme a valvulopatie e dilatazione atriale sinistra, possono generare aritmie sopraventricolari (es. fibrillazione atriale), che può promuovere instabilità emodinamica e significativo peggioramento della prognosi. L’ipertrofia ventricolare sinistra induce nelle fasi fisiopatologiche precoci, una funzione sistolica normale (o “supernormale” nel caso della CMPI: FE normale se > 70%) ma il disarray delle miofibrille ventricolari genera progressivamente anche alterazioni della funzione sistolica, sia nelle forme di ipertrofia primitiva che in quelle secondarie. Metodiche più sensibili rispetto alla valutazione della frazione di eiezione slatentizzano precocemente alterazioni della performance cardiaca: nel caso di CMPI, ad esempio, lo studio dello strain longitudinale esprime valori patologici sia a livello dei segmenti apicali del ventricolo che a carico del setto interventricolare medio anche in condizioni di normale FE. L’utilizzo della metodica Doppler nello studio ecocardiografico può confermare la presenza di ostruzione dinamica all’efflusso ventricolare (medio-ventricolare o sotto-aortico). Tale tipo di ostruzione viene definita “dinamica” perché generata durante la sistole, con picco pressorio in telesistole (aspetto “a sciabola” del gradiente transvalvolare aortico) generato dall’attrazione del lembo anteriore mitralico verso il setto interventricolare per effetto Venturi.
Questa condizione, pur non essendo univocamente associata alla CMPI, è maggiormente espressa in questa condizione rispetto alle altre condizioni di ipertrofia ventricolare sinistra, per i valori particolarmente alterati degli spessori ventricolari. In circa il 30% dei casi di CMPI l’ostruzione sottoaortica è presente in condizioni basali, e viene definita in caso di gradiente di picco > 30 mmHg; nel 50% dei restanti casi tale condizione può essere indotta da manovra di Valsava (oppure manovra di Hand-grip) se viene raggiunto un gradiente di picco> 50 mmHg. Forme più rare di fenotipo ipertrofico sono quelle del “miocardio non compattato”.
Tale condizione nosologica è tutt’ora soggetto di studio e classificazione, soprattutto in relazione ai diversi scenari clinici (soprattutto di natura aritmica) che possono verificarsi a parità di condizioni morfologiche. La non compattazione miocardica risulta essere nella maggior parte dei casi correlata a mutazioni genetiche che possono predisporre a cardiomiopatia dilatativa, sebbene, non infrequentemente, tale condizione sia coesistente a cardiopatia dilatativa e possa indurre possibili complicazioni di natura aritmica e reologica, come la formazione di trombi nelle zone miocardiche a bassa velocità di flusso. I criteri diagnostici utilizzati per la diagnosi di Non-compattazione miocardica sono molteplici, prevendono la contestualizzazione dei riscontri di imaging con i dati clinici ed anamnestici che hanno lo scopo di non indurre una over-diagnosi di tale patologia, anche in relazione alla non infrequente presenza di trabecolatura miocardica ridondante nella popolazione sana.
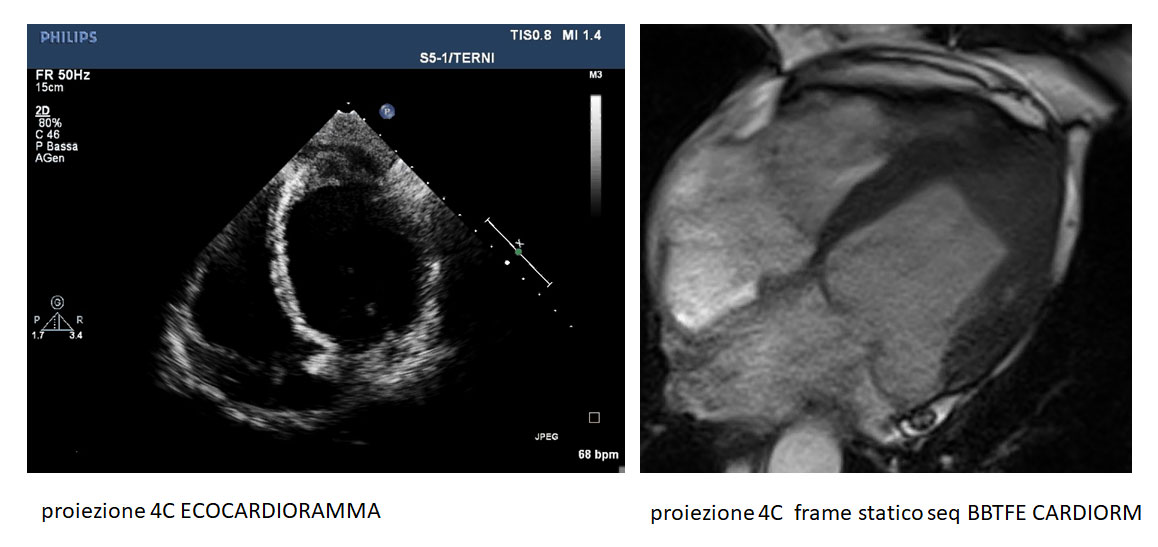
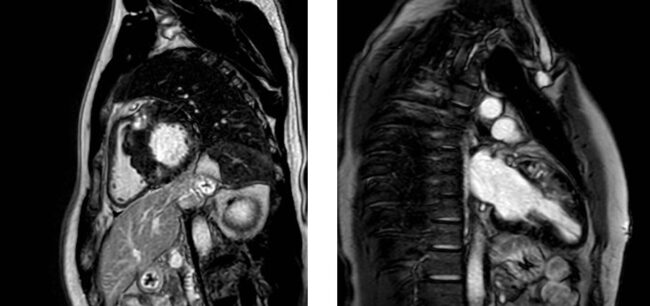
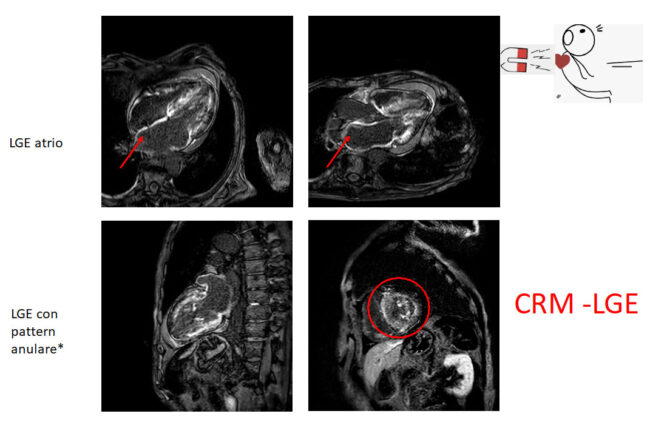
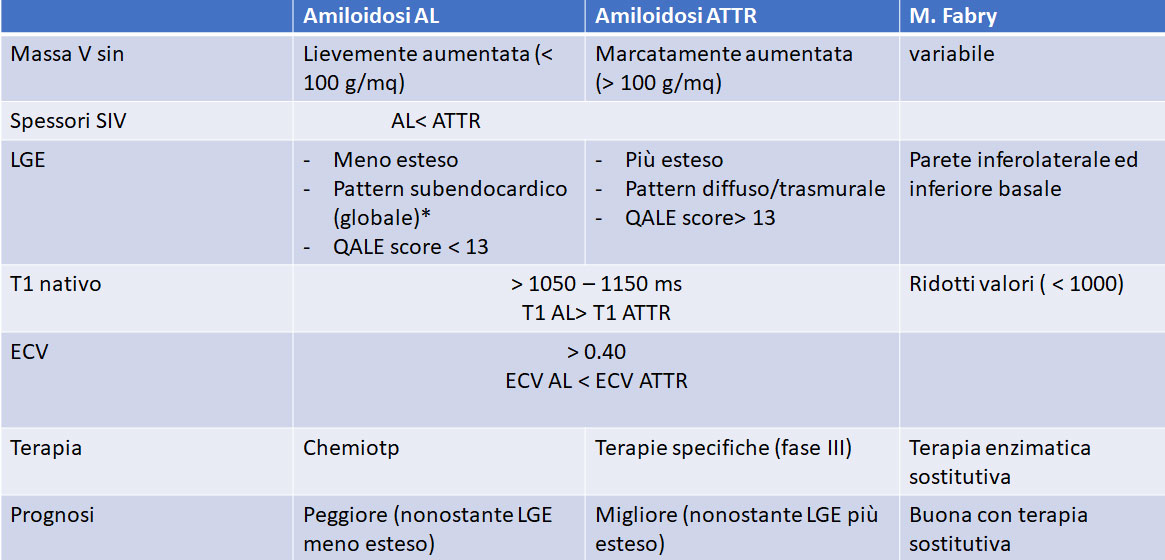
La maggiore risoluzione spaziale, la possibilità di acquisire immagini “full-volume” delle camere cardiache, e la possibilità di eseguire caratterizzazione tissutale (studio della fibrosi miocardica con Late Gadolinium Enhencement) rendono la Risonanza Magnetica Cardiaca (CRM) la metodica gold standard diagnostico nello studio delle cardiopatie a fenotipo ipertrofico validando o escludendo il sospetto diagnostico di cardiopatie primitive (es CMPI) rispetto a malattie da accumulo (es Amiloidosi o M. Fabry) che prevedono pattern LGE tipici oppure a fenocopie (cardiopatia ipertensiva o Cuore d’Atleta).
Riferimenti bibliografici:
1. Valutazione clinica della cardiomiopatia ipertrofica: ruolo dell’imaging multimodale Guido, Campana, Pino, Moreo, De Chiara, Bertella, Khoury, a nome dell’Area CardioImaging ANMCO.
2. I punti chiave nell’approccio clinico e diagnostico dell’ipertrofia ventricolare sinistra nell’adulto. Spunti dall’esperienza di ANMCO Lombardia Iacovoni, De Chiara, Sormani, Campana, Agostini, Faggiano, Occhi, Dadone, Raineri, Moreo, Di Tano, a nome del Gruppo di Studio ANMCO Lombardia.
3. Imaging nel cuore d’atleta: dalla diagnosi differenziale alla stratificazione del rischio Importanza dello screening cardiovascolare e del multi-modality Moreo, Campana, D’Andrea, Gimelli, Mele, Rizzo, Di Giannuario, Khoury.