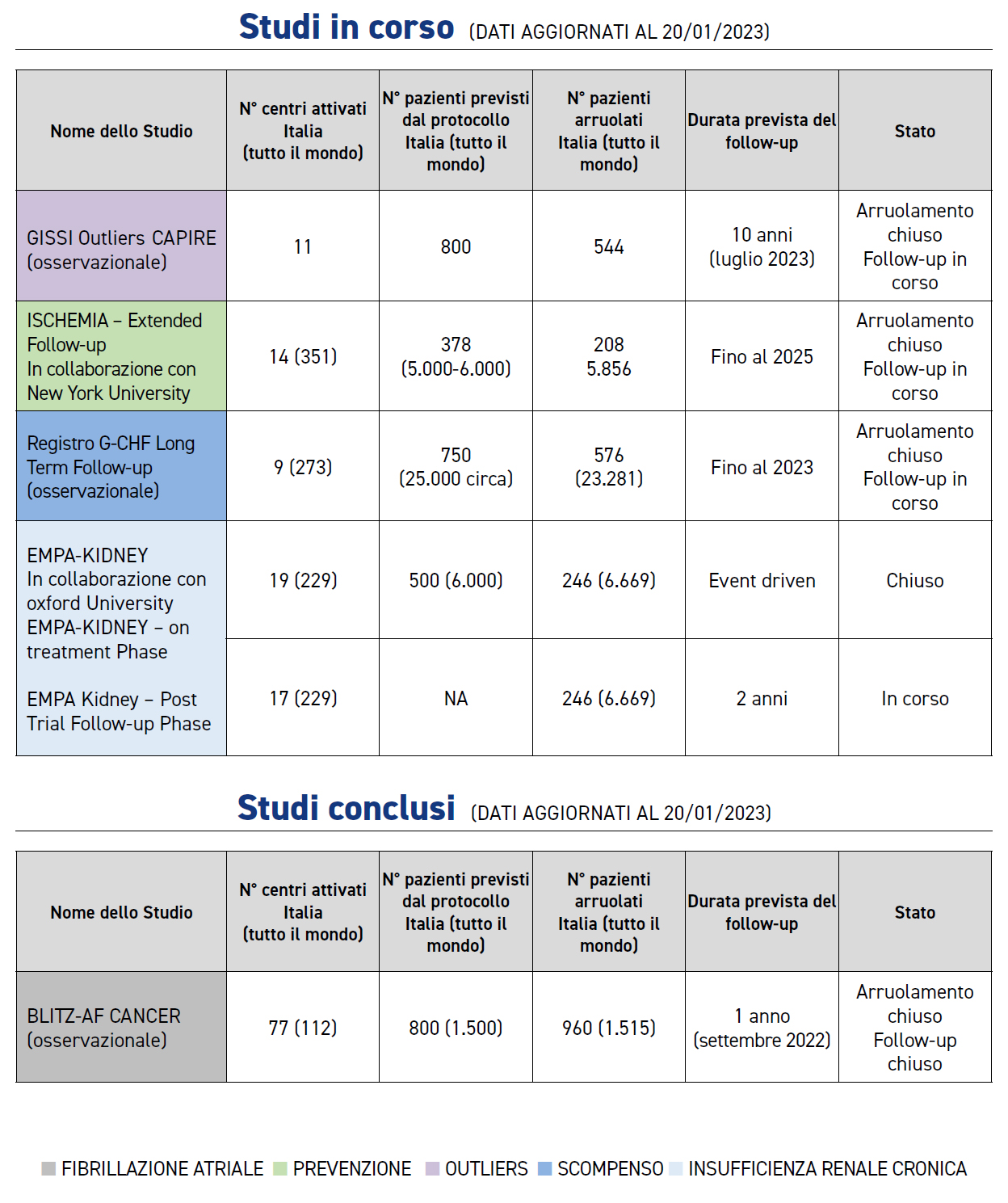
Studio BLITZ-AF CANCER
Steering Committee: Michele Massimo Gulizia (Chairman), Marco Alings, Furio Colivicchi, Rónán Collins, Leonardo De Luca, Marcello Di Nisio, Domenico Gabrielli, Stefan Janssens, Aldo Pietro Maggioni, Iris Parrini, Fausto J. Pinto, Fabio Maria Turazza, José Zamorano.
Lo studio BLITZ AF Cancer, promosso dalla Fondazione per il Tuo cuore Onlus di ANMCO e coordinato, sia a livello nazionale che internazionale, dal Centro Studi ANMCO della Fondazione per il Tuo cuore, è uno studio multicentrico, internazionale, osservazionale su pazienti con fibrillazione atriale (FA) e neoplasia (diagnosticata nei 3 anni precedenti l’inclusione nello studio) che ha arruolato 1.514 pazienti in 6 paesi europei (Italia, Belgio, Irlanda, Paesi Bassi, Portogallo e Spagna) tra giugno 2019 e settembre 2021.
Il follow-up ad 1 anno, previsto dal protocollo per descrivere eventi clinici e loro associazione alle modalità di trattamento antitrombotico, si è concluso in tutti i Paesi partecipanti il 7 novembre 2022 ed il database dello Studio è stato dichiarato “locked” il 2 dicembre 2022. La completezza del follow-up è stata del 99.2 %. Sono in corso le analisi dei dati, ed i risultati relativi al follow-up dello studio saranno presentati ai Ricercatori italiani a maggio p.v. in occasione del prossimo Congresso ANMCO.
EMPA-KIDNEY Trial
Lo studio EMPA-KIDNEY, studio clinico multicentrico internazionale randomizzato in doppio cieco, controllato con placebo, è stato disegnato dall’Università di Oxford per valutare l’effetto di empagliflozin sugli esiti cardio-renali in pazienti adulti con CKD. I Paesi partecipanti (UK, USA, Canada, Germania, Giappone, Cina, Malesia, Italia) sono stati coordinati a livello internazionale da Clinical Trial Service Unit (CTSU) dell’Università di Oxford e da Centri di Coordinamento Nazionali, tra i quali, per l’Italia, il Centro Studi ANMCO della Fondazione per il Tuo cuore.
EMPA-KIDNEY ha randomizzato 6.609 pazienti con CKD meno rappresentati negli altri trial con inibitori del SGLT- 2: pazienti con malattia renale non diabetica indipendentemente dall’eGFR/ UACR; pazienti con malattia renale diabetica con bassi livelli di albuminuria; pazienti con bassi livelli di funzione renale di base (ad es. eGFR <30) tipici dei pazienti seguiti in nefrologia. L’obiettivo primario era quello di valutare l’effetto di empagliflozin (10 mg/die) sull’end-point composito di morte per causa cardiovascolare o progressione della malattia renale (definita come end stage kidney disease, un declino prolungato di eGFR fino a <10 mL/min/1.73m2, morte da causa renale o un declino prolungato di eGFR ≥40% rispetto al valore alla randomizzazione). In seguito alla valutazione da parte del Data Monitoring Committee dei risultati dell’analisi ad interim di efficacia, prespecificata nel protocollo, lo Steering Committee ha deciso di chiudere lo studio anticipatamente per una chiara evidenza di efficacia terapeutica. Nel corso della primavera 2022 sono state eseguite le visite di fine studio ai pazienti ed i risultati sono stati presentati il 4 novembre 2022 nel corso della Kidney Week dell’American Society of Nephrology e contemporaneamente pubblicati sul New England Journal of Medicine (N Engl J Med. 2022 Nov 4. doi: 10.1056/NEJMoa2204233). I risultati dello studio sono stati inoltre presentati e discussi il 9 e 10 dicembre u.s. a Londra ai Ricercatori dei centri inglesi, italiani e tedeschi.
Nel corso del follow-up dello studio (durata mediana di 2 anni) l’end-point primario è occorso nel 13.1% dei pazienti trattati con empagliflozin e nel 16.9% dei pazienti trattati con placebo (HR 0.72, 95% CI 064-0.82, p<0.0001). I risultati sono consistenti nei pazienti con o senza diabete e indipendentemente dal valore di eGFR alla randomizzazione. Le ospedalizzazioni per qualsiasi causa sono state inferiori nel gruppo empagliflozin rispetto al placebo (HR 0.86; 95% CI 0.78-0.95; p=0.003), ma non si sono osservate differenze significative tra i gruppi per quanto concerne l’endpoint composito di ospedalizzazione per scompenso cardiaco o morte per causa cardiovascolare (4.0% nel gruppo empagliflozin e nel 4.6% nel gruppo placebo) ed il decesso per qualsiasi causa (4.5% nel gruppo empagliflozin e 5.1% nel placebo). Non sono stati evidenziati problemi di sicurezza relativi all’utilizzo di empagliflozin. È attualmente in corso la fase osservazionale di post-trial follow-up (PTFU) che avrà la durata di almeno 2 anni dall’interruzione del trattamento sperimentale ed è di estrema rilevanza per poter valutare gli effetti a lungo termine di empagliflozin sulla progressione della malattia renale. Ridurre la necessità di una costosa terapia renale sostitutiva potrebbe essere una informazione molto rilevante in termini di economia sanitaria. In Italia stanno partecipando al PTFU 17 dei 19 Centri che hanno partecipato alla fase randomizzata dello studio.