L’incidenza ed i fattori predittivi d’impianto di pacemaker nell’Amiloidosi Cardiaca da Catene Leggere e Transtiretina sono ignoti
Un’analisi retrospettiva multicentrica identifica fattori predittivi di impianto di pacemaker alla diagnosi di Amiloidosi Cardiaca per personalizzare le strategie di follow up cardiologico e monitoraggio clinico
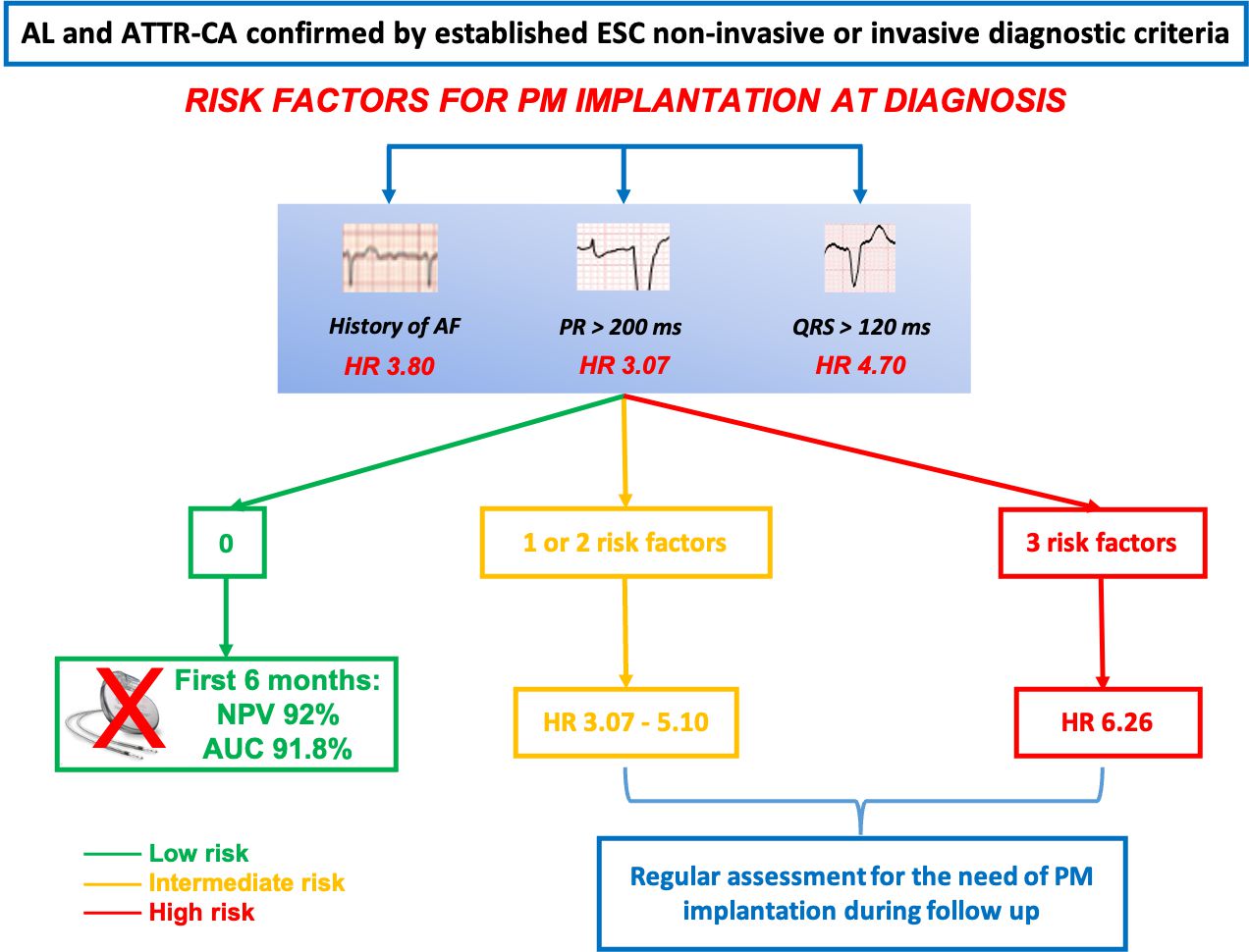
L’Amiloidosi Cardiaca (AC) è una causa emergente di scompenso cardiaco (SC) determinata dal fallimento dei meccanismi omeostatici con l’invecchiamento nella forma da transtiretina wild-type (ATTRwt), da mutazioni destabilizzanti la struttura proteica nella forma da transtiretina variante (ATTRv) o da un disordine ematologico nella forma da catene leggere (AL). Le aritmie e i disturbi del sistema di conduzione sono comuni nella AC, in particolare fibrillazione atriale (FA), disfunzione del nodo del seno e blocchi atrioventricolari (AV). I dati disponibili sulla prevalenza ed incidenza dell’impianto di pacemaker (PM) sono scarsi e si riferiscono prevalentemente alla forma da transtiretina (ATTR-AC) con il 10% dei pazienti già portatori di PM alla diagnosi e 11% con necessità di impianto PM nel follow-up. Per impulso delle società scientifiche ANMCO e SIC, per sensibilizzare su un’epidemiologia in evoluzione e per migliorare i protocolli di riconoscimento, inquadramento e gestione della malattia è sorta la rete italiana per l’amiloidosi cardiaca, coordinata dal Prof Claudio Rapezzi. In un recentissimo studio pubblicato su European Journal of Heart Failure, un gruppo di ricercatori delle Cardiologie italiane dei centri di Trieste (Ospedale di Cattinara), Firenze (Ospedale Careggi), Genova (Ospedale San Martino), Roma (Ospedale Sant’Andrea), Ferrara (Ospedale Santa Maria Cecilia), Padova (Ospedale Universitario) e Messina (Ospedale Universitario) ha indagato l’epidemiologia ed i fattori predittivi di impianto PM in una coorte retrospettiva (2017-2020) di 459 pazienti con ATTR-AC e ALAC. Alla diagnosi di AC, il 12% dei pazienti era portatore di un device cardiaco permanente (9% PM e 3% defibrillatore) e non è stata incluso nell’analisi di incidenza. La popolazione finale di studio constava di 405 pazienti: 83% uomini, età mediana di 76 anni, 25% con SC avanzato in NYHA 3–4, 42% con precedente storia di FA, spessore settale mediano di 17 mm, frazione d’eiezione mediana di 55%, con pattern restrittivo nel 37% dei casi. Ad un follow up mediano di 33 mesi (21-46), 36 (8.9%) dei 405 pazienti hanno impiantato un PM: 10 pazienti con AL-AC (8.4%), 2 pazienti con ATTRv-AC (3.4%) e 24 pazienti con ATTRwt-AC (10.6%). Il tempo mediano tra diagnosi di AC ed impianto è stato di 18 mesi: 13.5 mesi nella AL-AC, 40 mesi nella ATTRv-AC e 18 mesi nella ATTRwtAC. L’impianto PM era simile nella AL-AC e ATTR-AC all’analisi tempodipendente evento-specifica (p=0.65). All’analisi multivariabile, la storia di FA (hazard ratio [HR] 3.80, p=0.002), l’intervallo PR >200 ms (HR 1.013, p=0.002) e un intervallo QRS >120 ms (HR 4.7, p=0.001) all’ECG erano predittori indipendenti di impianto PM nel follow up in AL-CA e ATTRCA. I risultati sono stati confermati con l’analisi dei rischi competitivi per mortalità. Il rischio di impianto PM incrementava in presenza di un numero crescente di fattori. Il numero dei fattori di rischio presenti si associava ad indici ecocardiografici compatibili con una infiltrazione cardiaca progressivamente più severa. Inoltre, l’assenza di tutti e tre i fattori di rischio aveva un valore predittivo negativo del 92% (88-94%) con un’area sotto la curva (AUC) del 91.8% per impianto di PM nei primi 6 mesi dalla diagnosi di AC. Nella coorte analizzata in questo studio, l’impianto di PM nel follow up non si associava alla mortalità (p=0.1). Questo è il primo studio ad indagare l’incidenza ed i fattori associati all’impianto di PM in una coorte contemporanea di AL-AC e ATTR-AC, identificando predittori indipendenti di impianto PM nel follow up per una gestione personalizzata dei pazienti.